Berdasarkan keberlangsungan reaksi sel elektrokimia dibagi menjadi dua yaitu sel volta dan sel elektrolisis. Pada sel volta yang sedang digunakan, berlangsung suatu reaksi kimia yang menghasilkan arus/energi listrik. Sedangkan penggunaan energi listrik untuk melangsungkan reaksi kimia disebut sel elektrolisis. Perbedaan Pokok antara Sel Volta dan Sel Elektrolisis adalah sebagai berikut:
Sel Volta, terjadi pada reaksi redoks yang bersifat spontan (bereaksi dengan sendirinya) dan menghasilkan arus listrik. Dalam reaksi sel, perbedaan energi potensial kimia antara reaktan yang lebih tinggi energinya dan produk yang lebih rendah energinya menghasilkan arus listrik. Dengan kata lain sistem bekerja pada lingkungan . Katoda merupakan kutub positif dan anoda kutub negatif. Jadi dalam sel Volta energi kimia diubah menjadi energi listrik.
Sel Elektrolisis, terjadi pada reaksi redoks yang tidak spontan, sehingga untuk melakukan reaksi diperlukan energi. Energi yang diperlukan dalam sel elektrolisis adalah energi listrik dengan arus searah. Untuk berlangsungnya proses elektrolisis diperlukan adanya elektroda, larutan elektrolit, dan sumber arus listrik searah. Dalam sel elektrolisis katoda dihubungkan dengan kutub (-), dan anoda dihubungkan dengan kutub (+) sumber arus. Apabila arus listrik dialirkan ke dalam elektrolit, maka kation akan mengalami reduksi dengan menangkap elektron dan anion akan mengalami oksidasi dengan melepas elektron.
Untuk memudahkan kalian dalam memahami perbedaan dan persamaan antara sel volta dan sel elektrolisis, perhatikan gambar 3 berikut!
Berdasarkan Gambar 3 kedua rangkaian sel elektrokimia ini memiliki beberapa persamaan yaitu:
- Pada sel elektrokimia baik sel Volta maupun sel elektrolisis digunakan elektrode, yaitu katode, anode, dan larutan elektrolit
- Reaksi yang terjadi pada kedua sel tersebut adalah reaksi redoks. Pada katode terjadi reduksi dan pada anode terjadi oksidasi.
- Kedua sel harus memiliki larutan elektrolit (asam, basa, garam)
Sel volta
Bagaimanakah prinsip kerja sel volta sehingga dapat menghasilkan energi listrik?
Sel volta merupakan sel elektrokimia yang berlangsung spontan dengan menghasilkan energi listrik. Dalam sel volta, energi listrik dihasilkan dengan jalan pelepasan elektron pada suatu elektroda (oksidasi) dan penerimaan elektron pada elektroda lainnya (reduksi). Elektroda yang melepaskan elektron akan membentuk kutub negatif (-) dinamakan anoda, sedangkan elektroda yang menerima elektron akan membentuk kutub positif (+) dinamakan katoda. Jadi, sebuah sel volta terdiri dari dua bagian atau dua elektroda dimana setengah reaksi oksidasi berlangsung pada anoda dan setengah reaksi berlangsung pada katoda.
Misalkan logam Zn dan Cu dicelupkan ke dalam larutan elektrolit CuSO4 dan kemudian keduanya dihubungkan dengan kawat membentuk rangkaian sel volta sederhana. Apa yang akan terjadi?
Adanya perbedaan rapat muatan logam Zn dan Cu memungkinkan timbulnya aliran elektron dari Zn ke Cu melalui rangkaian luar pada sel volta. Apabila Zn dan Cu dicelupkan ke dalam larutan elektrolit atau air, maka ion-ion positif Zn2+ dan Cu2+ akan meninggalkan lempeng menuju larutan/air. Sedangkan elektron akan tertinggal di dalam lempeng. Ion-ion Zn2+ yang menuju larutan/air lebih banyak dari ion-ion Cu2+ yang menuju larutan/air. Dapat dikatakan bahwa Zn lebih mudah teroksidasi dibandingkan Cu (Simak deret volta). Akibatnya, elektron yang tertinggal di lempeng Zn lebih banyak dibandingkan elektron yang tertninggal di lempeng Cu. Dapat dikatakan bahwa rapat muatan Zn lebih besar dari lempeng Cu.
Adanya perbedaan rapat muatan menimbulkan perbedaan potensial antara kedua logam tersebut. Beda potensial ini memungkinkan elektron mengalir dari Zn ke Cu melalui rangkaian luar (kawat). Beda potensial antara logam Zn dan Cu tersebut dikenal sebagai gaya gerak listrik (ggl) atau electromotive force(emf).
Pada rangkaian di samping, logam Zn dan Cu disebut elektroda. Zn melepaskan elektroda (teroksidasi) membentuk elektrode negatif atau anode. Sedangkan Cu menerima elektron (tereduksi) membentuk elektrode positif atau katode.
Disini kalian dapat melihat bahwa telah terjadi transfer elektron melalui rangkaian luar sel. Oleh karena setiap e– membawa muatan listrik, maka dapat dikatakan reaksi redoks spontan telah menghasilkan arus listrik.
Namun, aliran elektron yang terjadi akan berlangsung sesaat dan kemudian berhenti. Dengan kata lain, tidak ada beda potensial lagi. Hal ini dikarenakan katode logam Cu telah dilapisi endapan Cu sebagai akibat reaksi reduksi Cu. Akibatnya, terjadi penumpukan muatan e– pada katode sehingga aliran elektron terhenti. Untuk mengatasi keadaan tersebut, sel dibagi menjadi dua setengah sel yang dihubungkan dengan selaput berpori atau jembatan garam.
Bagaimanakah rangkaian sel volta sehingga dapat menghasilkan arus listrik?
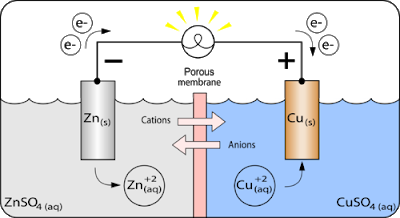
Perhatikan rangkaian sel volta pada gambar 10. pada rangkaian, logam Zn dicelupkan ke dalam larutan elektrolit ZnSO4 sementara logam Cu ke dalam larutan CuSO4. kedua logam kemudian dihubungkan dengan suatu rangkaian luar berupa kawat. Reaksi redoks spontan yang terjadi pada sel dapat dijelaskan sebagai berikut.
Pada anode, Zn teroksidasi menjadi ion Zn2+ kemudian pergi menuju larutan dan bereaksi dengan ion SO42-. Muatan elektron (e–) yang tinggal di anode akan mengalir melalui kawat menuju katode. Di katode, e- akan ditangkap oleh ion Cu2+ dalam larutan. Akibatnya, ion Cu2+ mengendap sebagai logam Cu pada permukaan katode.
Selama proses berlangsung, ion Zn2+ yang terbentuk akan pergi ke larutan ZnSO4. hal ini menyebabkan penumpukan ion positif Zn2+ dalam larutan. Akibatnya, larutan menjadi bermuatan positif, dan pada akhirnya ion Zn2+ tidak dapat lagi meninggalkan anode. Sementara itu, pada saat yang bersamaan di katode, perginya ion Cu2+ dari larutan CuSO4 ke katode untuk mengikat elektron dan mengendap, menyebabkan terjadinya penumpukan ion negatif SO42-. Kedua hal tersebut menyebabkan aliran elektron pada rangkaian luar akan terhenti. Untuk mengatasi hal ini, digunakan suatu rangkaian dalam, yakni jembatan garam. Jembatan garam mengandung ion-ion positif dan negatif yang berfungsi menetralkan muatan positif dan negatif dalam larutan elektrolit.
Sel Elektrolisis
Elektrolisis adalah peristiwa penguraian elektrolit dalam sel elektrolisis oleh arus listrik. Dalam sel volta/galvani, reaksi oksidasi reduksi berlangsung dengan spontan, dan energi kimia yang menyertai reaksi kimia diubah menjadi energi listrik. Sedangkan elektrolisis merupakan reaksi kebalikan dari sel volta/galvani yang potensial selnya negatif atau dengan kata lain, dalam keadaan normal tidak akan terjadi reaksi dan reaksi dapat terjadi bila diinduksi dengan energi listrik dari luar.
Contoh sel Volta adalah sel Daniel :
Zn + Cu2+ → Zn2+ + Cu E0 = 1,1 V
Reaksi sebaliknya tidak terjadi secara spontan, namun seandainya potensial lebih tinggi dari 1,1 V diberikan pada sel dengan arah kebalikan dari potensial yang dihasilkan sel, reaksi sebaliknya akan berlangsung. Jadi, zink akan mengendap dan tembaga akan mulai larut. Reaksi kebalikannya ini disebut elektrolisis. Pada elektrolisis tidak dihasilkan arus listrik melainkan membutuhkan sumber arus listrik agar reaksi terjadi (tidak spontan)
Contoh elektrolisis adalah :
Zn2+ + Cu → Zn + Cu2+
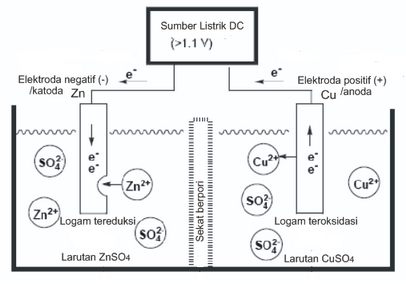
Elektroda positif (+) dari sel dihubungkan dengan kutub positif (+) dari sumber arus listrik
Elektroda negatif (-) dari sel dihubungkan dengan kutub negatif (-) dari sumber arus listrik
Pada elektroda positif (+)/anoda karena dihubungkan dengan kutub positif (+) yang potensialnya lebih besar menyebabkan terjadi reaksi oksidasi dan elektron mengalir dari elektroda ini menuju ke sumber arus listrik. Elektron bergerak dari kutub negatif (-) sumber arus listrik ke elektroda negatif (-)/katoda sehingga menyebabkan terjadi reaksi reduksi.